Western blot(蛋白印跡)作為科研研究中最為平常的實驗,卻蘊含了很多知識,可謂是小實驗里卻有大文章。盡管絕大多數研究僧在接觸該實驗時都會被虐的體無完膚,卻也在和WB斗志斗勇的過程中積累了不少經驗。正所謂前人種樹,后人乘涼,現在小魚就把各位前輩做WB的各種經驗總結起來,希望對大家能有所幫助。
WB的基本原理
在電場的作用下將電泳分離的多肽從聚丙烯酰胺凝膠轉移至一種固相支持體,然后用這種多肽的特異抗體來檢測,經常用于目的蛋白的表達特性分析、組織定位、表達量分析及與其他蛋白的互作。依其原理,可分為兩種方法:A、直接法和B、間接法。
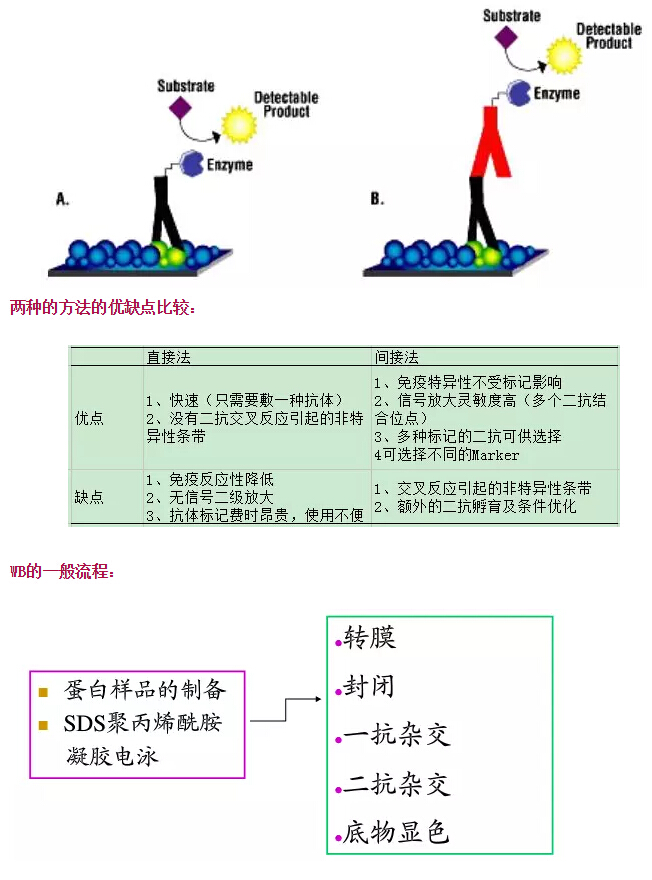
經驗總結:
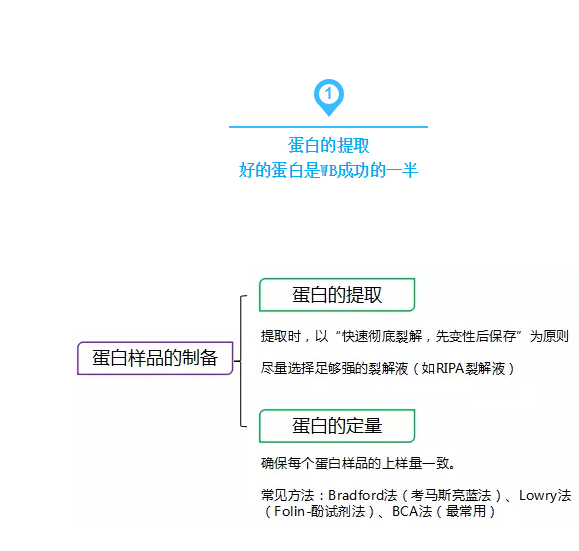
1:合適的鹽濃度下,保持蛋白質的最大溶解性和可重復性。
2:盡量除去核酸,多糖,脂類等干擾分子
3:提取蛋白質過程中,應在低溫環境下進行,以抑制蛋白酶的水解作用(可加入適合的蛋白酶抑制劑)。
4:蛋白樣品建議分裝后冷凍干燥或直接以液體態置-80℃中保存,不要反復凍融。
5:蛋白濃度低時,可使用超濾膜濃縮或者用真空凍干機將蛋白凍干。
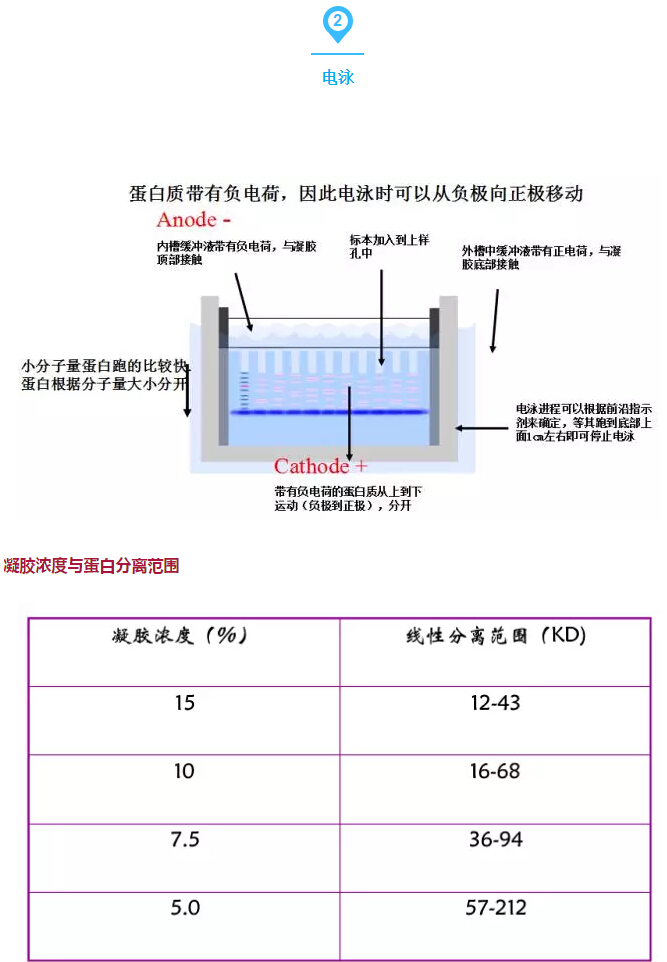
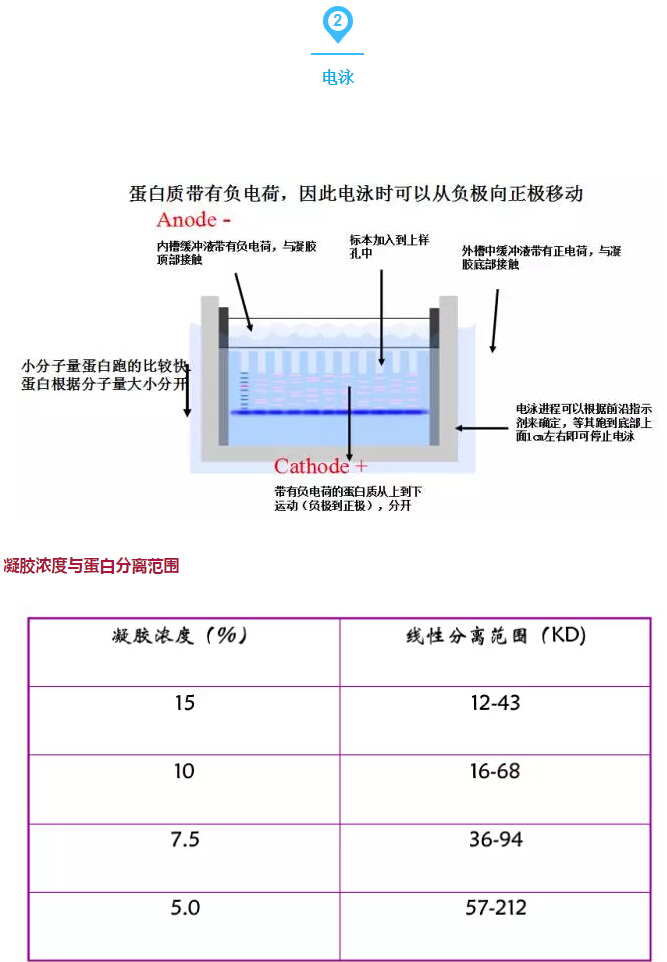
經驗總結:
1:上樣時:根據蛋白表達豐度調整蛋白上樣量,盡量保證每孔上樣量保持一致。
2:膠最好現配現用,如果需要保存,最好用濕潤的保鮮膜包好并置于4℃冰箱中。
3:為了檢測整個實驗系統或校準實驗結果,需要設置內參(一般指由管家基因編碼表達的蛋白)。

4:為了確保western blot結果的準確性和特異性,設置合適正確的對照是必不可少,一般需要設置的對照如下——
陽性對照:明確表達檢測蛋白的組織或細胞,用于檢測抗體的工作效率;
陰性對照:明確不表達檢測蛋白組織或細胞,用于檢測抗體的特異性;
二抗對照:不加一抗,用于檢測二抗的特異性;
內參對照:檢測標本的質量和二抗系統
空白對照:不加一抗和二抗;用于檢測膜的性質和封閉的效果。

用于western blot的雜交膜主要有兩種:NC膜和PVDF膜,可依據目的蛋白與膜的結合能力及膜的孔徑來挑選不同的轉移膜。
兩個膜之間的比較:
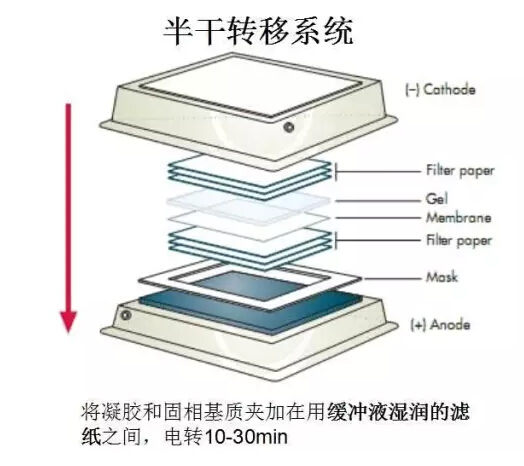
轉膜方法:分為兩種濕轉法和半干法
經驗總結:
1:膠在負極,膜靠近正極;濾紙不要大過膜,防止短路;
2:夾好膜和凝膠后,確定在凝膠、膜和濾紙之間沒有氣泡存在,否則會導致轉膜不完全。
3:注意一定要戴手套或塑料鑷子接觸膜,避免手上的蛋白和油脂降低轉膜效率。
4:轉膜過程中,尤其是高電流快速轉膜時,通常 會有非常嚴重的發熱現象,最好把轉膜槽放置在冰浴中進行轉膜。
5:對于濕轉法:一般轉膜的電流在200mA-400mA之間,轉膜時間為30-60分鐘。也可以在15-20mA轉膜過夜。大片段的>50KD的可以選用350mA,小片段的可以用250mA。具體的轉膜時間要根據目的蛋白的大小而定,目的蛋白的分子量越大,需要的轉膜時間越長,目的蛋白的分子量越小,需要的轉膜時間越短。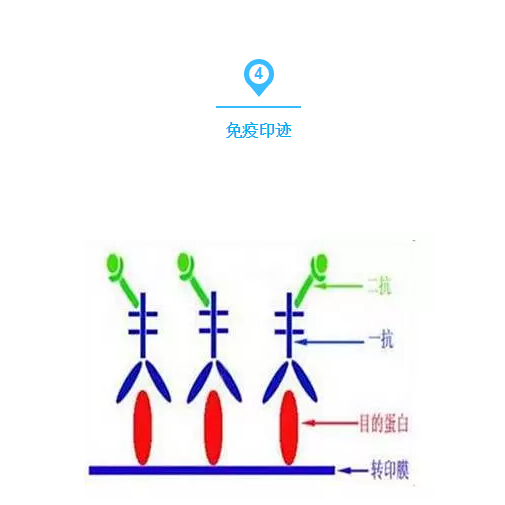
經驗總結:
1:常見的封閉液有5%脫脂奶粉、BSA和Western Blot膜封閉液(生物試劑公司提供)。但是封閉液的選取具體得看抗體說明書,有的抗體是明確要求只能用BSA,而封閉液濃度的選擇也是具體得看抗體的要求,但是一般情況5%BSA會比5%牛奶的效果好。
2:選擇抗體時,一方面需要考慮所選抗體是否能識別凝膠電泳后轉印至膜上的變性蛋白,另一方面需要考慮所選抗體是否會引起交叉反應條帶。

WB做完后,有時需要對結果進行定量。然而最備受推崇的定量分析軟件Quantiy One軟件因其高昂的售價令很多人望而卻步,但除了該軟件外還有一個比較簡單的圖像處理軟件ImageJ可以很方便的進行灰度和密度分析。
ImageJ的軟件界面
1.ImageJ對WB條帶進行灰度分析
1)File|Open打開WB結果圖片
2)圖片類型設置:Image|Type|8bit
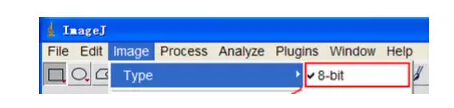
3)去除圖片背景:Process|Subtract Background
在Subtract Background窗口按照以下條件進行設置:
4)設置定量參數:Analyze |SetMeasurements,點擊Area,Mean Gray Value及Integrated Density
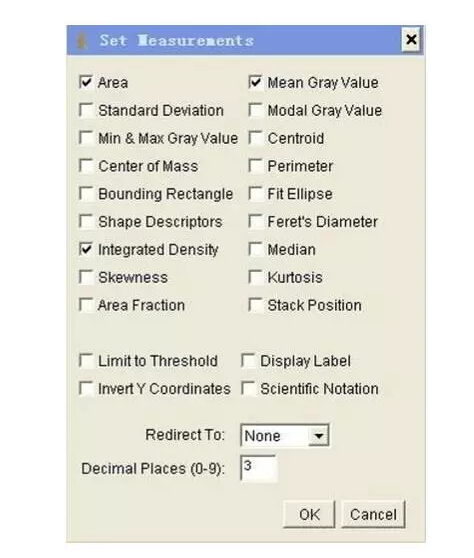
5)設置單位: Analyze|SetScale,在“unit of length”的方框里輸入“pixels”
6)將圖片轉換成亮帶,Edit|Invert

7)選擇Freehand Selection,盡量把條帶圈起來,點擊鍵盤m,出來IntDen灰度值
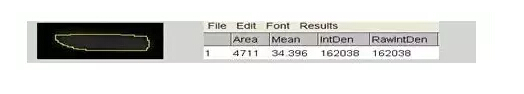
8)復制數據IntDen進行分析
2. Image J 對WB條帶進行密度分析
1)步驟同前,File|Open打開WB結果圖片
2)如果條帶不正,需修正

Image transform rotate調節angle值,直到條帶水平為止
3)選中矩形選項,圈中第一個條帶,AnalyzeGels Select Firstlane(快捷鍵Ctrl +1),然后移動第一個條帶上的矩形到第二個條帶上,Analyze Gels Select Second Lane(快捷鍵Ctrl+2),最后Analyze GelPlotlanes
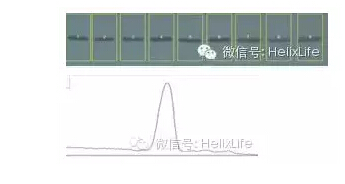
選中直線工具,將開口的波峰關閉

選中魔棒工具,點擊波峰可以顯示波峰下面積,即條帶的密度值

以第一個數值為基數,其他數值與第一個數值的比值即為相對密度。

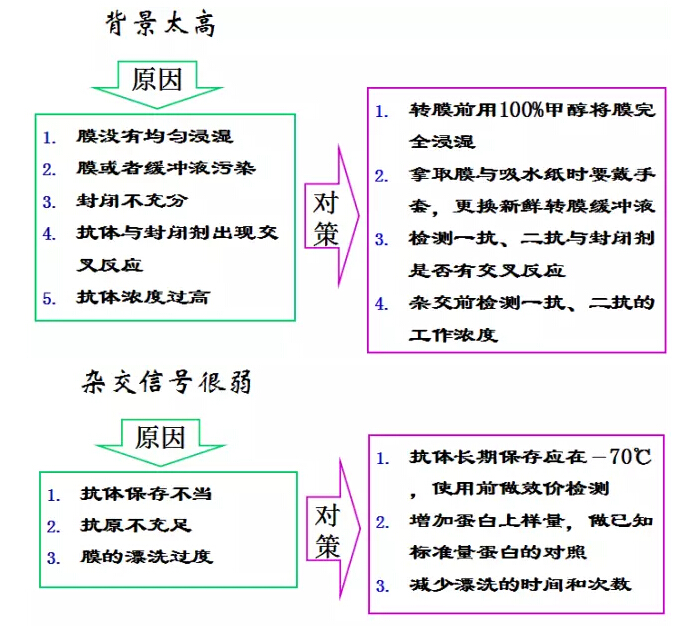
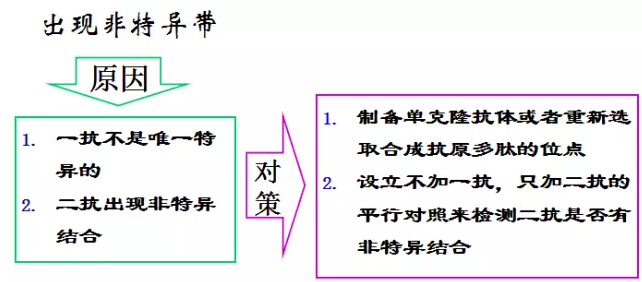
另附前輩們11條“濟世”經驗

1、抽提出某個蛋白第一次檢測,因為不知道表達量咋樣,可以減少裂解液(這樣蛋白濃度高一些),上樣量加大,抗體濃度大一點,增加出結果的幾率,否則出不來結果不知道是因為蛋白量太小還是抗體等其他條件影響,有結果后再根據條帶的亮度調整各種試劑的用量。
2、同時檢測兩種蛋白或兩個樣本的同種蛋白時,蛋白抽提出來后測濃度,調整每個孔的蛋白上樣量一致,通常做法時,做標準曲線,再計算待測蛋白的濃度,下面是偷懶的辦法:直接用酶標儀測這兩個樣品的吸光度,根據吸光度值將兩個樣品的蛋白濃度調整成一致后上樣。吸光度跟蛋白濃度成正比,沒必要一定要測量出具體濃度,而且只要使我研究的一對蛋白濃度調整一樣(對照組,處理組),沒必要將不同樣本的各組均調節成一個濃度。(懶人有懶人的活法,但是我懶得有原則)
3、科研小白注意黑膠白膜,黑膠白膜,黑膠白膜,重要的事情說三遍。轉膜是最好是將膜放在下面,膠放上面,否則會有鏡像效果,等轉完膜后拿出膜時,把膜反過來時,上樣順序會左右顛倒,因為膠無正反,膜有正反。
4、marker盡量不要放在中間,放在兩邊作為順序的標記,或者,在膠剝離出來后和PVDF膜的一角剪掉一小塊作為標記。(翻過來翻過去,咦,記不得哪邊是哪邊了)
5、封閉的時間可以延長問題不大,但是跑膠電泳時不能將膠長時間放在儀器里面,而應該放在轉膜液里固定(里面有甲醛,可固定蛋白),如果在沒有電流下蛋白一直在膠內 ,蛋白未被固定,會擴散,轉完膜后條帶難看。(甲醛是什么呀,就是大家經常報道的新裝修的房子甲醛超標,所以實驗狗不容易呀,每天跟這些有毒的東西打交道。)
6、封閉不一定要使用脫脂牛奶,3%BSA也可以,做磷酸化蛋白是盡量使用BSA可以降低背景。一般的實驗還是用便宜的脫脂牛奶。
7、如果一次性需要檢測多個蛋白,電泳后可根據marker(即分子量)將膜剪開,分別不同的抗體孵育,可一次檢測多個蛋白;當兩個蛋白分子量很相近PVDF膜無法剪開時,可先曝表達弱的蛋白,再用抗體洗脫液將已結合的一抗、二抗洗去,這樣一張印跡膜可以多次使用,再曝表達強的蛋白,但注意的是此種方法可由于劇烈處理丟失某些表位。
8、買一個抗體孵育槽可以節省抗體的使用量,每個小槽可以孵一張膜。(土豪請忽略這一條,哪里買,問淘寶)

9、內參因為使用量大,市面上有帶HRP的內參出售(言外之意就是一抗上面就帶HRP,就不用孵二抗了),前幾次摸條件時,用帶HRP的內參,可以直接一抗后先曝下內參,如果內參不齊,目的基因暫時就不用孵育了,等調節蛋白上樣量一致后再去檢測目的基因。
10、抽提蛋白時全程都要在冰上, 因為加了細胞裂解液后細胞被破壞,細胞內的各種酶被釋放,如果不在冰上操作,蛋白容易降解,如果開始抽提蛋白,建議一次性操作到加上loading buffer煮蛋白變性的步驟,煮蛋白的將蛋白變性,后不易降解,如果要長期保存,放到-20度。
11、頻繁做WB時,可以一次可以多配幾塊電泳膠,running buffer 4度保存,省的每次配膠。
